《2016 NCCN宫颈癌临床实践指南》解读
宫颈癌是全球范围排名第4位的常见恶性肿瘤,也是女性面临的主要健康问题。2012年全球宫颈癌发病数为52.8万例;年死亡数为26.6万例。2016年预计美国新发宫颈癌12 990例,死亡4120例。85%的宫颈癌病例发生在发展中国家,也是这些地区癌症死亡的主要原因。最近美国国立综合癌症网络(NCCN)公布了《2017宫颈癌临床实践指南》。为使大家更好地了解新版指南,现对其进行简要解读。本指南的诊治建议适用于鳞状细胞癌、腺癌和腺鳞癌,其他病理类型的宫颈癌不在本指南的讨论范围。
1 新版本的主要更新
(1)新增“影像学检查原则”部分,包括初始处理和后续随访中影像学检查的原则。(2)“考虑前哨淋巴结(SLN)显影”的推荐从2B类提高为2A类。(3)RT(放疗)在指南中被定义为“EBRT”(外照射)。(4)ⅠA1期无淋巴脉管间隙浸润不保留生育功能者,锥切术后如切缘阳性,首选再次锥切评估浸润深度,再决定下一步治疗范围。(5)主动脉旁淋巴结阳性同时存在远处转移的患者,建议行全身化疗±个体化外照射。(6)复发病例在治疗前需经病理证实。
2 分期
仍采用FIGO 2009临床分期。淋巴脉管间隙浸润(LVSI)不改变分期。MRI、CT或联合PET-CT有助于制定治疗计划,但不改变原来的分期。手术分期尚未引入分期中。临床检查包括病史、体检、宫颈活检或锥切、全血细胞计数(包括血小板)和肝肾功能。在有指征的情况下采用影像学检查,怀疑膀胱或直肠侵犯时应用膀胱镜或直肠镜检查。
3 手术原则
宫颈癌的治疗根据临床分期进行分级治疗。
3.1 保留生育功能适用于仔细选择的患者 (1)微小浸润癌即ⅠA1期、无淋巴脉管浸润者极少有淋巴转移,保留生育功能者可行锥切。ⅠA1期伴淋巴脉管浸润者也可行锥切(切缘需阴性),加腹腔镜下盆腔SLN显影或盆腔淋巴结切除。锥切目的是切除部分宫颈及宫颈管。推荐冷刀锥切。锥切的形状和深度需与病灶大小、形状和瘤变部位相适应。例如,对于宫颈管的可疑浸润性腺癌与原位腺癌,锥形活检应设计成一个窄长锥形,延伸至宫颈内口以避免遗漏宫颈管病变。锥切术有诊断性锥切和治疗性锥切。如果能达到整块切除、足够的切缘和合适的形状、小心操作以减少电器械对组织边缘的影响,环形电切术(LEEP)也是可接受的。有指征者加宫颈管搔刮(ECC)。(2)经阴道广泛宫颈切除术加腹腔镜下淋巴结切除(有或无前哨淋巴结定位)用于经仔细筛选的ⅠA2期或ⅠB1期病灶直径≤2 cm需要保留生育功能患者。宫颈、阴道上段及子宫支持韧带的切除范围同B型广泛性子宫切除术,但保留子宫体。经腹广泛性宫颈切除术较经阴道手术能切除更多的宫旁组织,适用于病灶直径2~4 cm 的ⅠB1期患者。手术范围类似C型广泛性子宫切除术。(3)小细胞神经内分泌癌和腺癌不适合保留生育功能。
3.2 广泛性子宫切除术加双侧盆腔淋巴结切除术(有或无前哨淋巴结显影) 是ⅠA2、ⅠB、ⅡA期无生育要求患者首选的治疗方法。广泛性子宫切除术较单纯子宫切除术切除了更多宫旁组织,包括部分主韧带、子宫骶骨韧带和阴道上段(ⅠA2期1~2 cm,ⅠB1或ⅡA1期切除阴道的1/4或1/3)以及盆腔淋巴结,必要时切除腹主动脉旁淋巴结。广泛性子宫切除术可以选择经腹、腹腔镜或机器人辅助腹腔镜技术。QM分型是较新的分型,详见表1。
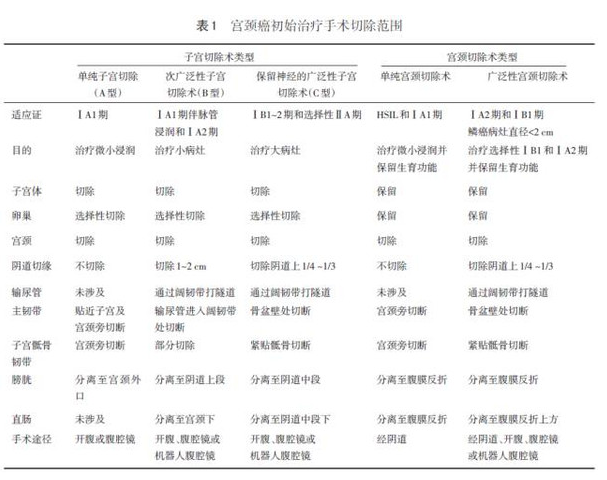
3.3 ⅡB期及以上的晚期病例通常不采用子宫切除术 在美国,大多数晚期患者采用放化疗。在其他国家,部分ⅠB2期病例可能首选广泛性子宫切除术或新辅助化疗后进行广泛性子宫切除术。
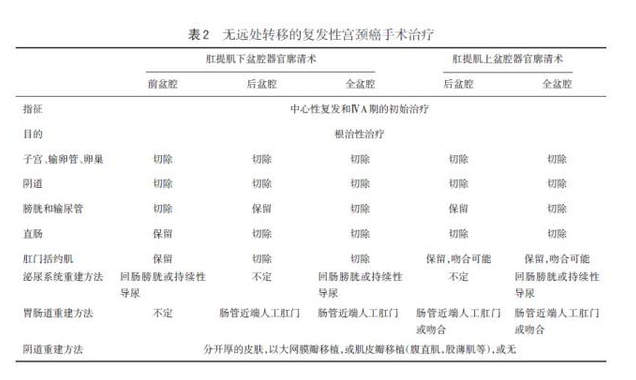
3.4 盆腔器官廓清术 对于放疗后盆腔中心性复发或病灶持续存在者有治愈的可能。术前需明确是否存在远处转移。如果复发仅限于盆腔,可进行手术探查。未侵犯盆壁及淋巴结者可切除盆腔器官。根据肿瘤的位置采用前、后或全盆腔器官廓清术。若有足够的手术切缘,可保留盆底和肛门括约肌。
表2总结了盆腔器官廓清术的不同类型及切除范围。盆腔器官廓清术很少用于初始治疗,仅用于不宜盆腔放疗或因既往患有其他疾病,已接受过盆腔放疗或局部晚期宫颈癌不适合盆腔放疗的患者。
3.5 前哨淋巴结显影 该技术已经被应用于经选择的Ⅰ期宫颈癌患者手术程序中。尽管可用于病灶直径达4 cm的患者,但肿瘤直径<2 cm时检测率和显影效果最好。操作时可直接在宫颈的3和9点或3、6、9、12点位置注射染料或放射性胶体99mTc。通过注射吲哚菁绿(ICG)者用荧光摄像头显影;注射99mTc者使用γ探测器探测;注射染料者直接肉眼观察,从而在术中识别前哨淋巴结。前哨淋巴结通常位于髂外血管内侧、侧脐韧带外侧或闭孔窝的上部分。显像的关键技术是严格按照以下检测流程:切除所有显影的淋巴结(这些淋巴结如HE染色无转移,病理专家需采用更高级的检测技术)→切除任何可疑淋巴结(不论有无显影)→一侧没有显影淋巴结时,切除该侧髂内和髂外等高危淋巴结→肿瘤和宫旁组织整块切除。这些结果可为术后的辅助治疗提供依据。
4 放疗原则
4.1 外照射(external-beam radiation therapy,EBRT) 以CT为基础的放疗计划辅以适形挡板是EBRT的标准方案。MRI是判断肿瘤浸润周围软组织和宫旁组织的最佳方法。PET 有助于未手术的患者判断淋巴结转移情况。EBRT需要覆盖整个病灶区域及宫旁组织和子宫骶骨韧带、骶前淋巴结及其他可能受累淋巴结和足够的阴道组织(至少在病灶外3 cm)。如手术或影像学检查未发现肿大淋巴结,放射野需要包括髂外淋巴结、髂内淋巴结和闭孔底部。如发生淋巴结转移的风险较大,放射野还需要覆盖髂总淋巴结区。如果发生髂总或腹主动脉旁淋巴结转移,则需要进行延伸野外照射,包括腹主动脉旁,上界达到肾血管水平(放疗野可能需要进一步向头侧延伸,以包括受累淋巴结)。
治疗镜下微小淋巴结转移灶时,外照射剂量约为45 Gy(分割放疗时,常规每天1.8~2.0 Gy),如果存在大块局限性病灶,则需要追加高度适形放疗,剂量为10~15 Gy。多数接受外照射的宫颈癌患者同期会接受含铂方案化疗使用顺铂单药或顺铂+氟尿嘧啶(5-FU)。
对于子宫切除术后的患者,IMRT与其他高度适形放疗有助于减少肠道和其他重要器官放射剂量。同样适用于因区域淋巴结肿大而需要接受大剂量放疗的患者。但是对于宫颈未切除且伴有中心性病变的患者,近距离照射仍然是首选。在使用调强放疗等适形放疗技术时,应尤其重视计划的设计,注重细节、保证计划具有可重复性。准确界定靶区和正常组织、考虑患者接受放疗时内脏器官的运动、软组织的形变、定期进行物理质量控制是成功应用适形技术的重要保证。锥形束CT可有助于明确内部软组织定位。总靶区(GTV)、临床靶区(CTV)、计划靶区(PTV)、器官风险(OARs)、剂量体积直方图(DVH)等概念已经被应用于适形放射治疗,特别是IMRT中。立体定向放疗(SBRT)可针对某特定区域行高剂量外照射放疗,或许是一种治疗孤立转移灶的方法。
4.2 近距离放疗 近距离放疗是以放疗为初始治疗患者治疗方案的重要组成部分。常可通过腔内施源器(宫腔内管和阴道插植物保持器)完成。可根据患者及肿瘤的解剖特点来选择近距离放疗时使用的阴道部件,包括卵圆体、环状体和阴道圆筒,这些阴道部件都与宫腔内管相连。放疗前MRI有助于检测出残余肿瘤几何形状。如果患者需接受EBRT,多数情况下可在放疗后期进行近距离放射治疗,这时肿瘤体积已明显缩小,近距离放疗器械容易到达合适的位置。部分极早期患者(如ⅠA2期),单用近距离放疗即可治愈。对于肿瘤形态较特殊无法进行近距离放疗的患者最好由专家完成间质插植放疗。
已切除子宫的患者(尤其是阴道黏膜切缘阳性或近切缘的患者)可通过使用阴道圆筒完成EBRT增强放疗。SBRT并非能替代近距离放疗。A点代表宫颈旁参考点,一直是最广泛使用的参数。但是,点的计量系统的局限性并没有考虑到肿瘤的三维形状及肿瘤与正常组织结构的相关性。以MRI、CT或超声图像为基础的容积近距离放射治疗方法正逐渐使用并规范化。
4.3 放疗剂量 近距离放疗时最常用剂量参数系统对“A点”进行明确定义,此外还会依据解剖特点规定子宫和阴道中“放射性源放置和活性区域”的具体方法及要求。B点、膀胱点和直肠点接受的放射剂量也需要计算。有研究者正在致力于通过“3D影像学技术”引导近距离放疗,使肿瘤充分接受到植入照射剂量同时更好地保护邻近器官如膀胱、直肠和肠管。但是所有研究和经验以及进行效果比较时,都要以A 点剂量系统为基础。使用影像学技术引导进行近距离放疗时,需注意提高肿瘤和A点接受的放疗剂量比。
推荐使用的A点剂量系统是以分割和低剂量近距离放疗系统为基础。进行EBRT时,推荐的放疗分割方案为每天1.8~2.0 Gy。近距离放疗A点接受的剂量是通过低剂量40~70 cGy/h给予。如果使用高剂量率(HDR)技术进行近距离放疗,则需通过线性二次方模型等式将HDR额定A点剂量转换为A 点的低剂量率(LDR)生物学等价剂量。目前联合使用EBRT时,可用的近距离放疗方法有很多种,最常用的HDR方法是使用5个插植物,包括宫腔内管和阴道插植物保持器,每一个插植物在A点释放的标准剂量为6 Gy。使用这种方法进行HDR化疗时,A点在5次分割放疗后接受到的总剂量为30 Gy,如果使用LDR技术完成近距离放疗时,剂量达到40 Gy也是可以接受的。
4.4 初治病例的根治性放疗 未接受手术具有完整宫颈的患者根治性EBRT的总放疗剂量多为45 Gy(40~50 Gy)。放疗体积依据手术或影像学检查确定的淋巴结状态而定。联合使用近距离放疗时,原发宫颈病灶接受到的剂量将增加,增加的剂量为A 点30~40 Gy(通过LDR等剂量技术),这时A点接受的总剂量可达到80 Gy(宫颈病灶体积较小)或≥85 Gy(宫颈病灶体积巨大)。对于明显增大且未切除的淋巴结,需要使用高度适形EBRT追加放疗,额外给予10~15 Gy。当放疗剂量较大,尤其使用EBRT时,需要特别注意正常组织能接受的放疗耐受剂量,应严格控制位于高剂量区内正常器官接受的剂量,避免过量照射。
4.5 子宫切除术后的辅助放疗 子宫切除术后病理学检查发现高危因素时要进行术后辅助放疗。放疗野至少需要包括以下位置:阴道断端下3~4cm、宫旁组织和邻近淋巴结基底部(如髂外淋巴结和髂内淋巴结)。有淋巴结转移时放疗野的上界需要外延。推荐进行标准分割放疗,剂量为45~50 Gy。对于明显增大的淋巴结,需要通过高度适形EBRT追加放疗剂量10~15 Gy。
4.6 术中放疗(intraoperative radiation therapy,IORT) IORT是指在开腹手术时,对存在风险的瘤床区域或无法切除的孤立性残留病灶进行单次、靶向、大剂量放疗。尤其适合放疗后复发。进行IORT时,可直接将正常组织(如肠管和其他器官)从放疗危险区中排开。放射源的形态可提前设计(与手术确定的危险区域相匹配),可限制照射的面积和深度,避免周围正常组织接受不必要的照射。
5 化疗原则
宫颈癌的全身化疗适用于盆腔外转移病例或不适合放疗或手术的复发病例。
5.1 一线联合化疗 顺铂一直被认为是转移性宫颈癌最有效的药物。以顺铂为基础的联合方案如顺铂+紫杉醇+贝伐单抗(1类)、顺铂+紫杉醇(1类)、顺铂+拓扑替康(2A类),已广泛用于临床研究。GOG 169进行了顺铂+紫杉醇联合方案和顺铂单药的比较,前者反应率、无进展生存期均优于顺铂单药。GOG 179针对顺铂+拓扑替康联合方案与顺铂单药比较。拓扑替康联合方案被证明在反应率、无进展生存期及中位生存时间均优于顺铂单药。美国食品和药品管理局(FDA)已经批准顺铂、拓扑替康用于晚期宫颈癌。顺铂+紫杉醇联合或卡铂+紫杉醇联合方案因毒性较低更易于管理。GOG 204对4种顺铂双药方案(顺铂+紫杉醇,顺铂+拓朴替康,顺铂+吉西他滨,顺铂+长春瑞滨)进行了比较。顺铂+紫杉醇优于其他方案,而且血小板减少症和贫血症发生率更低。GOG 240研究了含贝伐单抗的联合化疗方案(顺铂+紫杉醇+贝伐单抗或拓朴替康+紫杉醇+贝伐单抗)。接受贝伐单抗的患者总生存期改善(17.0 个月vs.13.3个月,P=0.004)。而拓朴替康+紫杉醇(2A类)未显示出优于顺铂+紫杉醇。虽然贝伐单抗导致了更高的毒性(例如:高血压、血栓栓塞事件和胃肠瘘),但不具有统计学意义。FDA最近批准贝伐单抗与紫杉醇和顺铂或拓扑替康联合用于治疗持续性、复发性或转移性宫颈癌。
日本临床肿瘤研究组(JCOG)0505Ⅲ期临床研究结果显示,卡铂+紫杉醇(2A类)较顺铂+紫杉醇用于转移或复发性宫颈癌总生存期相当而且具有更好的耐受性,便于毒性反应的管理。但在之前未接受过铂类药物的患者中,TP方案(紫杉醇+顺铂)的总生存期高于TC 方案(紫杉醇+卡铂)。推荐:卡铂+紫杉醇作为接受过顺铂治疗的患者1类选项。研究认为顺铂+紫杉醇和卡铂+紫杉醇是转移性或复发宫颈癌应用最广泛的方案,对于不能使用紫杉醇的患者,可采用顺铂+拓扑替康或顺铂+吉西他滨替代。
5.2 单药化疗 顺铂是最有效的化疗单药,被推荐作为一线单药药物治疗复发或转移性宫颈癌患者。对于无法接受手术或者放射治疗的复发患者,单药顺铂、卡铂或紫杉醇姑息化疗都是合理的方案。其他已被证实有效或能延长无进展生存期(PFS)可用于二线治疗的药物包括:贝伐单抗、多西他赛、5-FU、吉西他滨、异环磷酰胺、伊立替康、丝裂霉素、拓朴替康、培美曲塞(3级证据)和长春瑞滨(3级证据)。其他药物如疫苗及靶向治疗疗效尚不确切。
6 影像学检查原则
指南中提及的MRI及CT均为增强检查,除非有禁忌证时使用平扫。胸部CT不要求增强。
6.1 初始检查
6.1.1 Ⅰ期 不保留生育功能者可胸部平片,若有异常,则可行CT平扫检查;选择性MRI增强检查评估局部病灶范围(ⅠB2期首选推荐);FIGO分期ⅠB2期可考虑全身PET-CT或胸部、腹部、盆腔CT检查;全子宫切除术后意外发现宫颈癌的患者考虑全身PET-CT或胸部、腹部、盆腔CT检查以评估转移情况,行盆腔MRI评估盆腔残留病灶。保留生育功能者行胸部平片,若有异常行CT平扫检查;首选盆腔MRI以评估病灶范围以及与宫颈口距离,若不适宜MRI检查,则行经阴道超声检查;根据临床症状及可疑转移病灶诊断,选择其他影像学检查。
6.1.2 Ⅱ~Ⅳ期 全身PET-CT或胸部、腹部、盆腔CT检查以评估转移情况;盆腔MRI增强检查评估局部病灶范围;根据临床症状及可疑转移病灶诊断,选择其他影像学检查;全子宫切除术后意外发现宫颈癌的患者考虑全身PET-CT或胸部、腹部、盆腔CT检查以评估转移情况,行盆腔MRI评估盆腔残留病灶。
6.2 随访检查
6.2.1 Ⅰ期 非保留生育功能患者影像学检查的选择应根据临床症状及复发/转移而决定; ⅠB2期患者或术后有高危因素需接受辅助放疗及放化疗的患者,治疗结束3~6个月后可行全身PET-CT检查;保留生育功能患者术后6个月考虑行盆腔MRI平扫+增强检查,之后的2~3年间每年做1次;若怀疑出现转移,则可考虑行全身PET-CT检查;其余影像学检查的选择应根据临床症状及复发/转移考虑而决定。
6.2.2 Ⅱ~Ⅳ期 治疗结束后3~6个月内行全身PET-CT检查(首选)或胸部、腹部、盆腔CT平扫+增强检查;治疗结束后3~6个月后选择性行盆腔MRI平扫+增强检查;其余影像学检查的选择应根据临床症状及复发、转移考虑而决定。
7 各期宫颈癌的初始治疗方法
7.1 ⅠA1 期无淋巴脉管间隙浸润 建议先锥切。有适应证的患者增加宫颈搔刮术(ECC)。锥切目标是达到切缘阴性(无浸润性病变或高度鳞状上皮内病变)。保留生育功能者如切缘阴性(标本最好整块切除,病灶边缘距离切缘>3 mm),术后可随访观察。如切缘阳性,再次锥切或行广泛性宫颈切除术。目前尚无数据支持小细胞神经内分泌肿瘤,肠型腺癌或微偏腺癌等病理类型患者保留生育功能。强烈建议术后持续性异常巴氏涂片或HPV感染患者在完成生育后切除子宫。不保留生育功能者如切缘阴性并有手术禁忌证者,可观察随访。切缘阴性无手术禁忌证者建议行筋膜外子宫切除术。切缘阳性(不典型增生或癌)建议再次锥切评估浸润深度,切缘为癌者也可直接行筋膜外或次广泛性子宫切除术+盆腔淋巴结切除术(证据等级为2B),可考虑行前哨淋巴结显影(证据等级为2A)。
7.2 ⅠA1 期伴淋巴脉管间隙浸润和ⅠA2 期 保留生育功能者可选择:(1)锥切(标本最好整块切除,病灶边缘距离切缘>3 mm)+盆腔淋巴结切除±主动脉旁淋巴结取样(证据等级为2B)。可考虑行前哨淋巴结显影(证据等级为2A)。切缘阴性者,术后随访观察。切缘阳性者,再次锥切或行广泛性宫颈切除术+盆腔淋巴结切除±主动脉旁淋巴结取样(证据等级为2B)。(2)直接行广泛性宫颈切除术+盆腔淋巴结切除±主动脉旁淋巴结取样(证据等级为2B)。可考虑行前哨淋巴结显影(证据等级为2A)。完成生育后对于持续性人乳头瘤病毒(HPV)阳性或细胞学异常或有手术意愿的患者可行子宫切除,45岁以下的鳞癌患者可保留卵巢。不保留生育功能者可选择:(1)次广泛或广泛性子宫切除术+盆腔淋巴结切除术±主动脉旁淋巴结取样(证据等级为2B)。可考虑行前哨淋巴结显影(证据等级为2B)。45岁以下的鳞癌患者可保留卵巢。(2)盆腔外照射+近距离放疗。
7.3 ⅠB1 和ⅡA1 期 保留生育功能的ⅠB1期鳞癌患者,推荐行广泛性宫颈切除术+盆腔淋巴结切除±主动脉旁淋巴结取样。可考虑行前哨淋巴结显影(证据等级为2A)。原则上推荐选择肿瘤直径<2 cm者,可选择经阴道行广泛性宫颈切除术。肿瘤直径2~4 cm者,应行经腹或经腹腔镜、机器人辅助腹腔镜的广泛性宫颈切除术。不保留生育功能者可选择:(1)广泛性子宫切除术+盆腔淋巴结切除±主动脉旁淋巴结取样(1 级证据)。可考虑行前哨淋巴结显影(证据等级为2A)。45岁以下的鳞癌患者可保留卵巢。(2)盆腔外照射+阴道近距离放疗(A 点总剂量80~85 Gy)±顺铂为基础的同期化疗。
7.4 ⅠB2 和ⅡA2 期 可选择:(1)盆腔外照射+顺铂同期化疗+阴道近距离放疗,A 点剂量≥85 Gy(1级证据)。(2)广泛性子宫切除术+盆腔淋巴结切除±主动脉旁淋巴结取样(2B 级证据)。(3)盆腔外照射+顺铂同期化疗+近距离放疗,A 点剂量75~80Gy,放疗后行辅助性子宫切除术(3 级证据)。以上3种推荐中,首选同期放化疗。第3种选择同期放化疗之后进行辅助性子宫切除术还存在争议。该做法可减少盆腔复发、不改善总生存率,但却增加并发症,故只适用于放疗结束后仍有肿瘤残留,或病灶或子宫已超出近距离放疗所能涉及放疗区域的患者。腹腔镜手术可能可以减少术后并发症。
7.5 ⅡB、ⅢA、ⅢB、ⅣA 及部分ⅠB2 和ⅡA2 期 可选择手术分期,也可先进行CT、MRI、PET等影像学评估。
选择先行影像学检查者,若影像学未发现淋巴结转移,可行盆腔外照射+顺铂同期化疗+阴道近距离放疗;影像学发现肿大淋巴结可考虑穿刺活检。若盆腔淋巴结阳性、主动脉旁淋巴结阴性时,可选择:(1)盆腔外照射+阴道近距离放疗+顺铂同期化疗(1级证据)±主动脉旁淋巴结放疗。(2)腹膜外或腹腔镜淋巴结切除术,当主动脉旁淋巴结阴性时,行盆腔放疗+阴道近距离放疗+顺铂同期化疗(化疗为1级证据);主动脉旁淋巴结阳性者,可行延伸野放疗+阴道近距离放疗+顺铂同期化疗。影像学检查发现盆腔淋巴结和主动脉旁淋巴结均阳性时,可考虑行腹膜后或腹腔镜淋巴结切除术,术后延伸野放疗+顺铂同期化疗+阴道近距离放疗。影像学检查发现有远处转移者,若有临床指征可在可疑处活检证实转移,然后进行全身化疗±个体化外照射。
手术分期是指先行腹膜外或腹腔镜下淋巴结切除术(均为2B 级证据),若淋巴结均阴性,可采用盆腔外照射+含顺铂同期化疗+阴道近距离放疗(化疗为1级证据)。若淋巴结阳性,应根据阳性淋巴结所处的位置做进一步处理:(1)盆腔淋巴结阳性但主动脉旁淋巴结阴性者,可行盆腔外照射+含顺铂同期化疗+阴道近距离放疗(1 级证据)。(2)主动脉旁淋巴结阳性者,可先行影像学检查,确定无其他远处转移时,行延伸野外照射+含顺铂同期化疗+阴道近距离放疗。如果有远处转移,在可疑处活检,活检阴性时行延伸野外照射+顺铂同期化疗+阴道近距离放疗,活检阳性者行全身化疗±个体化外照射
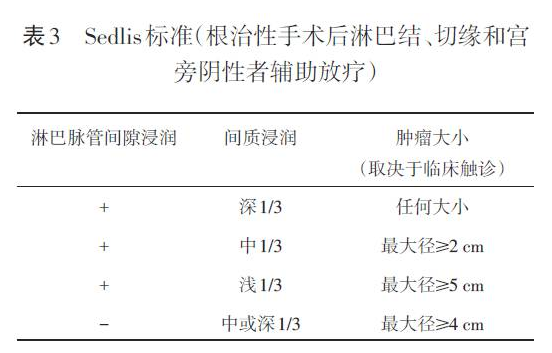
7.6 术后辅助治疗 取决于手术发现及分期。没有淋巴结转移、宫旁浸润及切缘阴性者,可以观察或根据是否存在中危因素增加盆腔外照射放疗(1 级证据)±顺铂同期化疗(化疗为2B级证据)。中危因素采用“Sedlis标准”,见表3。淋巴结阳性、切缘阳性和宫旁浸润被认为是“高危因素”。具备任何一个“高危因素”均推荐术后补充盆腔外照射+顺铂同期化疗(1级证据)±阴道近距离放疗。阴道切缘阳性者,阴道近距离放疗可以增加疗效。主动脉旁淋巴结阳性者,可行影像学检查明确是否存在远处转移。如未有转移建议行主动脉旁淋巴结外照射+顺铂同期化疗+盆腔放疗±阴道近距离放疗;如合并远处转移,可先在可疑处活检,活检阴性者行主动脉旁淋巴结放疗+顺铂同期化疗+盆腔放疗±阴道近距离放疗,活检阳性者则采用全身化疗±个体化外照射。
7.7 意外发现的宫颈癌 意外发现的宫颈癌是指单纯筋膜外子宫切除术后意外发现的浸润性宫颈癌。对其处理包括完善病史、体格检查、血常规(含血小板)和肝肾功能检测。可选择的影像学检查包括胸片、CT和PET-CT,如有指征做MRI。对于ⅠB1期或更小的肿瘤,不需常规进行影像学检查。对于无淋巴脉管间隙浸润的ⅠA1期患者,可随访观察。对于有淋巴脉管间隙浸润的ⅠA1期或ⅠA2期或更高期别的肿瘤,取决于切缘状态。如果切缘阳性、影像学检查阴性,建议行盆腔外照射+含顺铂同期化疗±个体化近距离放疗。切缘和影像学检查均阴性并无高危和中危因素者,可选择:(1)盆腔外照射±含顺铂的同期化疗+阴道近距离放疗。(2)宫旁广泛切除加阴道上段切除+盆腔淋巴结切除±腹主动脉旁淋巴结取样。如果有中危因素(如原发肿瘤大、深部间质浸润、淋巴脉管间隙浸润),建议行盆腔外照射±阴道近距离放疗。对肉眼见病灶残留、影像学检查阳性、淋巴结±宫旁阳性和(或)手术切缘阳性的患者,建议行同期放化疗。阴道切缘阳性者,建议行个体化近距离放疗。
7.8 妊娠合并宫颈癌 宫颈癌是合并妊娠女性中最常见的妇科恶性肿瘤,大多数为Ⅰ期患者。选择延迟治疗直至胎儿成熟还是立即接受治疗是患者和医生必须做出的困难选择。推迟治疗直至胎儿成熟的患者应该接受剖宫产,并可在剖宫产的同时行广泛性子宫切除术和盆腔淋巴结切除术。经阴道广泛性宫颈切除术已在部分早期宫颈癌患者中成功实施。对那些选择放疗的患者,传统的放疗±化疗也许需要做适当调整。
8 随访
建议治疗后2年内每3~6个月随访1次,第3~5年每6~12个月1次,5年后每年随访1次。高危患者应缩短随访间隔(如第1~2年每3个月1次),低危患者随访间隔可以较长(如6个月1次)。至少每年进行1次宫颈-阴道细胞学检查。随访时需进行仔细的临床评估,教育患者了解提示复发的症状,如阴道排液,体重减轻,厌食,盆腔、髂关节、背部或腿部疼痛等。鼓励患者停止吸烟或减少吸烟。随访过程中不需常规进行影像学检查,有症状或怀疑复发时可应用。复发病例在治疗前需经病理证实。对于肿瘤未控或复发者,在治疗前需要进一步的影像学检查或手术探查来评估病情。
9 复发性宫颈癌的治疗
局部复发的病例,如果既往没有接受放疗或者复发部位在原来放疗野之外,能切除者可以考虑手术切除,后续个体化外照射加或不加化疗及阴道近距离放疗。再次复发的患者建议参与临床试验或化疗或支持治疗。放疗后中心性复发者可考虑盆腔器官廓清术,加或不加术中放疗(IORT)(3级证据)。复发病灶直径≤2 cm的中心性复发,也可以考虑行广泛性子宫切除术或阴道近距离放疗。对于非中心性复发者,可选择个体化外照射±化疗或切除加术中放疗或参加临床试验或化疗或支持治疗。远处转移适合局部治疗者,可选择手术切除±外照射或局部消融±外照射或个体化外照射±同步化疗,还可用化疗。不适合局部治疗者建议参与临床试验或化疗或最好的支持治疗。
10 指南更新和个人意见
10.1 新版指南新增加影像学检查原则 指导临床医生在治疗前和治疗后针对患者的病情和经济情况选择合适的影像学检查。当然,目前多数影像学项目仍较昂贵,需考虑患者的经济情况加以选择。
10.2 新版指南重视了前哨淋巴结的应用 应用前哨淋巴结可以减少术后淋巴水肿的发生率。
10.3 ⅠA1 期无淋巴脉管间隙浸润不保留生育功能者,锥切术后如切缘阳性(切缘阳性包括宫颈高级别病变或癌) 推荐首选再次锥切评估浸润深度和宽度,再决定手术范围。因为如果不重复锥切后再次评估,直接手术需至少行次广泛性子宫切除加盆腔淋巴结切除术。如果仅行筋膜外全子宫切除术,有可能手术范围不够,需补充治疗。这是我们觉得指南中值得商榷的地方。
10.4 关于诊断性锥切用冷刀或LEEP问题 我们推荐用LEEP。作为以诊断为目的的锥切,对后续手术的影响是越小越好,手术也越简单越好。只要能做到整块切除,LEEP的切除范围完全能满足明确分期的需要,指导确定后续手术范围。
我要评论

共0条评论